Original English version: http://people.csail.mit.edu/seneff/statins_muscle_damage_heart_failure.html
av Stephanie Seneff
[email protected]
28 januar 2010.
1. Introduksjon
Statin narkotika har økt jevnt de siste tiårene, på grunn av den utbredte troen på at kolesterolreduksjon er et viktig skritt i å forebygge hjertesykdom. Det er mulig at statiner er effektive: de kan redusere serumkolesterolnivåer fra over 300 db/ml til godt innenfor normalområdet i løpet av noen uker. For en person som allerede har normale kolesterolnivåer, kan statiner kjøre sitt kolesterol ned til nivåer ikke sett i naturen. Statiner har også vist seg å redusere relative risikoen for hjerteinfarkt hos menn i 50 årene med så mye som 30%, men fordi hjerteinfarkt er relativt sjelden at dette segmentet av befolkningen, den absolutte er risikoreduksjon bare i størrelsesorden 2%, et punkt som ofte blir oversett av den personen som blir behandlet.
Alle legemidler har potensielle bivirkninger, og med noen narkotika det er et spørsmål om veiing av risiko/nytte faktorer for å avgjøre om stoffet er garantert. Statinene har en bemerkelsesverdig variert sett av bivirkninger, inkludert kognitiv og svekket hukommelse, redusert libido, og muskelsmerter og svakhet. Stoffet produsenter hevder at forekomsten av bivirkninger er relativt sjelden, men ofte bivirkninger ikke vises før etter flere måneder eller år i behandling. I mange av disse tilfellene kan det ikke være opplagt at statin narkotika er årsaken til problemet. Dette gjelder spesielt fordi disse bivirkningene kan lett tilskrives økende alder. Faktisk, som jeg vil vise senere, statin bivirkninger best kan tolkes som en akselerering av aldringsprosessen.
Etter mitt syn, statin narkotika er aldri verdt risikoen for deres bivirkninger. Kolesterol er et viktig næringsstoff, uten noe som pattedyrceller ikke kan overleve, og det er utenkelig for meg at lamma kroppens evne til å syntetisere kolesterol kan noensinne være en god idé. I en utmerket og svært informativ oversiktsartikkel publisert i 2009, Wainwright et al. [43] utviklet et sterkt argument som statin medikamenter, ved tappe kolesterol, føre til en destabilisering av cellemembraner “fra topp til tå.” Dette problem, i sin tur øker risikoen for en lang rekke alvorlige helsetilstander og sykdommer, inklusive diabetes , multippel sklerose, kognitive problemer, hemoragisk slag, kreft, og til og med ALS (amyotrofisk lateral sklerose, også kjent ofte som Lou Gehrigs sykdom). Deres argumenter er støttet av referanser til 85 fagfellevurderte tidsskriftet publikasjoner. Jeg har argumentert for i tidligere essays som statiner kan øke risikoen for å Alzheimers sykdom, så vel som til sepsis, kreft, og hjertesvikt.
De mest vanlige rapporterte bivirkninger til statinterapi er muskelsmerter og svakhet. Hvis venstre ukontrollert, kan disse symptomene utvikle seg til rhabdomyolyse (alvorlig muskelskade) og nyresvikt. Muskelsvakhet i lungene kan føre til pustevansker; i hjertet fører det til hjertesvikt. Statinbrukerne blir beroliget ved sine leger at de kan stanse statinterapi hvis deres lever og muskel enzymer bli for høy. I praksis er det imidlertid mulig å lide irreversible muskelskade (problemet ikke forsvinner etter at statinbehandling er stoppet), og dette kan skje selv når enzymnivået er ikke over normalområdet.
Dette essayet vil utvikle et argument for hvorfor, over tid, kan et statin brukeren blir stadig svakere, i noen tilfeller til poenget med større funksjonshemming. En viktig melding er at musklene blir tvunget til å slutte seg til å skaffe tilstrekkelig energi. Men en annen faktor er oksidativ skade på muskelvevet, med påfølgende nedbrytning av celleveggene. Dette gjelder ikke bare for skjelettmusklene, men også for de respiratoriske muskler kontrollere pust og hjertemuskelen. Med fortsatt misbruk, muskelcellene i oppløsning, og rusk reiser i blodstrømmen til nyrene, noe som kan føre til nyresvikt.
Resten av denne artikkelen vil utfolde som følger. I neste avsnitt, vil jeg forklare hvordan statin narkotika arbeid, noe som også vil vise hvorfor de forstyrrer syntesen ikke bare av kolesterol, men også av andre viktige biologiske stoffer involvert i celle metabolisme. Det følgende avsnitt vil gi bevis på at statiner skade muskelceller. §4 og §5 beskrive biokjemiske mekanismer som er involvert i å sikre at musklene har nok energi til å utføre bevegelser, spesielt i situasjoner med stress som ekstrem trening. Seksjon 6 beskriver tilstanden kjent som rabdomyolyse, forårsaket av ekstrem utøvelse men også ved statinene, og den påfølgende risiko nyresvikt. Seksjon 7 beskriver rollen som myoglobin, en nøkkel protein som finnes i muskelceller, spiller i sykdomsprosessen. Etter at en seksjon som forklarer hvordan kolesterol beskytter cellemembraner fra oksidativ skade, vil de fire etterfølgende avsnitt (seksjoner 9-12) må rettes mot følgene av statin skade på musklene, hjertet, lungene og bukspyttkjertelen, henholdsvis. Til slutt vil konklusjonen delen oppsummere essay og gi tips om min kommende essay om ALS, en fysisk invalid nevrodegenerativ sykdom som skyldes ikke til muskelskader per se, men å skade av motoriske nerveceller i ryggmargen som overfører signaler fra hjernen til skjelettmusklene.
2. Biologisk Mekanisme Statinene
Hvorfor statiner føre til så mange bivirkninger? For å besvare dette spørsmålet må forklare alle viktige roller som kolesterol spiller i å opprettholde integriteten og funksjon av kroppens celler. Imidlertid statiner forstyrrer ikke bare med syntesen av kolesterol, men også med syntesen av et enzym, koenzym Q10, som spiller en kritisk rolle i energimetabolismen i alle celler. En mangel på både kolesterol og koenzym Q10, over tid, fører til en enorm liste over potensielle helseproblemer. Nøyaktig hvordan en person reagerer avhenger av deres genetiske make-up: overfor en mangel, vil kroppen bestemmer seg for å ofre visse celletyper for å ivareta visse andre celletyper. Så kan en person utvikle Alzheimers fordi hjernens nerveceller blir ofret.
Statiner undertrykke en kritisk tidlig trinn i flertrinns biologisk reaksjonsvei som fører til kolesterolsyntese. Dette er grunnen til at statiner er i stand til å dramatisk redusere blodserumnivåer av kolesterol. Nærmere bestemt, statiner interferere med produksjonen av enzymet, HMG-A-reduktase, som katalyserer fremstillingen av mevalonat fra dens forløper, HMG-koenzym A. 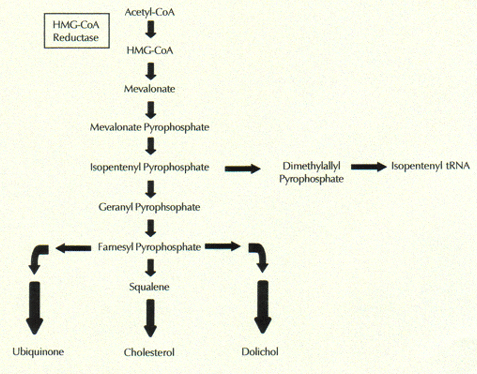 Enda flere trinn produserer kolesterol fra mevalonat. Mevalonat er også en forløper til et stort antall av andre biologisk aktive molekyler som er viktig for riktig cellefunksjon. Disse inkluderer antioksidanter, koenzym Q10 og dolichols, som vist i figuren til høyre.
Enda flere trinn produserer kolesterol fra mevalonat. Mevalonat er også en forløper til et stort antall av andre biologisk aktive molekyler som er viktig for riktig cellefunksjon. Disse inkluderer antioksidanter, koenzym Q10 og dolichols, som vist i figuren til høyre.
Den såkalte “dårlige” kolesterolet, LDL, leverer kolesterol, fett og antioksidanter fra leveren til alle cellene i kroppen. Alle celler trenger både fett og kolesterol for å opprettholde sunne membraner, ikke bare i den ytre cellevegg, men også i membraner som omhyller kjernen, mitokondriene (energiproduserende enheter), og lysosomer (cellens fordøyelsessystemet). Antioksidanter er kritiske for å nøytralisere de skadelige virkninger av oksygen eksponering, alltid et problem når energi blir generert i mitokondriene gjennom en kjemisk reaksjon mellom matvarekilder og oksygen.
I en dobbelt-blind, placebokontrollert studie [18], er det blitt vist at statiner kan redusere serumnivået av koenzym Q10 med så mye som 40%. Koenzym Q10 er ikke bare en kraftig antioksidant, men det spiller også en avgjørende rolle i den prosess som bryter ned glukose i nærvær av oksygen under dannelse av karbondioksyd og vann. Denne metabolismen, som er i det vesentlige brenning av glukose som brennstoff, finner sted i mitokondriene via den velkjente sitronsyre, eller Krebs-syklus. Den energi som frigjøres ved denne prosess er pakket opp i form av ATP (adenosin trifosfat), den valuta at alle cellene bruke til å lagre sine energireserver.
De dolichols spille en spesiell rolle for lysosomene [20]. Lysosomene er vegger av “rom” som inneholder fordøyelsesenzymer for å bryte ned rester av ødelagte celledeler, slik at de kan resirkuleres til nyttige materialer. Lysosomer må opprettholde en sterkt sur indre miljø i rekkefølge for fordøyelsesenzymer til å fungere ordentlig. De dolichols er ansvarlige for pumping av hydrogenioner inn i lysosomene for å holde dem svært sure.
En avsluttende måte som statiner kan skade cellene er gjennom sine inngangs mekanisme. Statiner hører til en klasse av legemidler som kalles “amfifile” narkotika [2] som klarer å bryte gjennom celleveggen på tross av å være forholdsvis stor. De opptrer som en såpe ved i det vesentlige å oppløse en del av cellemembranen. Dette etterlater seg et hull i veggen, som trenger å bli oppdatert opp, samt avfall som må renses opp og resirkulert av lysosomene. Å lappe hullet krever nye kilder for både fett og kolesterol, som kommer fra LDL-partiklene, hvis tilførsel er sterkt redusert på grunn av statinet stoffet. Slik at det blir stadig vanskeligere over tid for cellen for å reparere alle hullene innført av statin medikamentmolekyler. Etter hvert som celleveggen blir mer gjennomtrengelige på grunn av tidligere eksponering til et amfifilt legemiddel, mengden av legemiddel som vellykket kommer inn i cellen stadig øker over tid, hvilket fører til stadig større indre konsentrasjoner av medikamentet.
3. Statiner, Muskelsmerter Og Svakhet, Og Rabdomyolyse
Muskelceller har store energibehov, spesielt hvis personen har blitt satt på en øvelse diett som en del av sitt behandlingsopplegg. Hjertet, særlig hviler aldri. Det har å holde på å slå 24 × 7 til en kurs på minst én gang hvert sekund. Derfor hjertet er spesielt avhengig av koenzym Q10 å etterfylle ATP forbrukes hver gang det kontrakter og presser blod fra ett kammer til en annen og ut i aorta.
Den farmasøytiske industrien lett innrømmer at statinterapi kan forårsake muskelsmerter og/eller muskelsvakhet i noen tilfeller, men de hevder at forekomsten av disse bivirkninger er meget liten, i størrelsesorden 2%. Imidlertid har observasjonsstudier vist at minst 10% til 15% av statinbrukerne klager over muskelsmerter [6] [40]. Det faktiske antallet som opplever smerte eller svakhet er sannsynlig å være mye større, men fordi mange mennesker er uvitende om at dette er en potensiell bivirkning. Videre, noen ganger tar det flere år med akkumulert statin skader før symptomene blir uutholdelig. Folk er ofte villige til å tro at deres smerter og generelt svekket tilstand er rett og slett på grunn av å bli eldre.
Reaksjonen fra general samfunnet til et relativt godartet artikkel postet av WebMD på muskelsmerter tyder på at problemet er mye verre enn det som er generelt anerkjent. Over 200 ofte lange kommentarer beskrive mange svært triste historier; ofte legen ble også feilinformert, og benektet at smertene kan skyldes statinet stoffet. Et eksempel på dette er beskrevet i denne New York Times artikkelen. En kvinne i Kansas hadde vært å ta et statin i årevis for å redusere sitt kolesterol. Over den samme tidsperioden, opplevde hun kroniske muskelsmerter som verken hun eller hennes lege tilskrives statinbehandling. Det førte også til en ubrukelig skulder operasjon. Hennes problem videresendt til slutt inn i hudskader forårsaket av en reaksjon for å giftig protein biprodukter som frigis av hennes desintegrerende muskler. Hun fikk en soppdrepende å behandle hudskader, en annen feildiagnostisering. Men det antifungale interaksjon med statiner [25] for å ytterligere øke alvorlighetsgraden av sine muskelforstyrrelser. Tre måneder senere, hun kunne knapt stå, og hennes lunge musklene var så svak at hun ikke fikk puste. Hun døde kort tid etterpå.
Rabdomyolyse er en tilstand hvor musklene raskt løses opp som følge av en skade, ofte, for eksempel fysisk trauma etter en ulykke. Men Rabdomyolyse er også en sjelden bivirkning av statiner – i hovedsak hvor muskelsmerter og svakhet er ekstreme. Noen reagerer umiddelbart for å statinbehandlingen med alvorlig rabdomyolyse, og det er ofte dødelig, på grunn av akutt nyresvikt (ARF). Myoglobin er sloughed av fra muskelcellene i store mengder, og det overbelaster nyrene og får dem til å stenge helt. Initierende statinterapi er derfor litt som russisk rulett – det er enda et kjent tilfelle hvor en enkelt dose forårsaket statin rabdomyolyse [21]. En av statiner, Baycol, ble brått tatt av markedet i 2001, etter at 31 personer døde av påfølgende rabdomyolyse.
4. Hvordan Muskler Opprettholde sin Energiforsyning
I denne delen, og den neste, vil jeg beskrive de metabolske veier involvert i å sikre at muskelcellene har nok energi til kontrakt. Når oksygen er tilgjengelig, og når den trygt kan utnyttes, kan muskelen dekomponere næringskilder til karbondioksid og vann, ved å forbruke oksygen. Men oksygen, mens livgivende, er også et veldig farlig stoff, og hvis prosessen ikke er orkestrert helt etter planen, kan det være mange sivile tap som følge av feil stoffer som reagerer med oksygen. Som du vil se senere, myoglobin, som er ansvarlig for bufring oksygen og levere den fra celleveggen til mitokondriene, plukker opp mye av den sivile tap. Dette aerobic metabolske prosessen kalles åndedrett, og det foregår inne spesielle organeller som kalles mitokondrier.
Når oksygen er en mangelvare, eller hvis mitokondriene er dysfunksjonelle, har cellen alternative måter å generere energi (f.eks gjæring), som finner sted i fravær av oksygen, i hovedrommet i cellen, kalt cytoplasma. Disse prosesser krever utveksling av næringsstoffer mellom musklene og leveren, og de krever assistanse av spesielle enzymer som deretter vises i blodstrømmen. Disse er de samme enzymene hvis konsentrasjoner blir overvåket for å detektere hvorvidt et statin medikament kan ha skadet musklene.
Hvis du ikke føler seg tvunget til å kjenne detaljene i hvordan alle disse prosessene fungerer, kan du hoppe over dette avsnittet og § 5, og, tror jeg, fortsatt kunne følge resten av historien.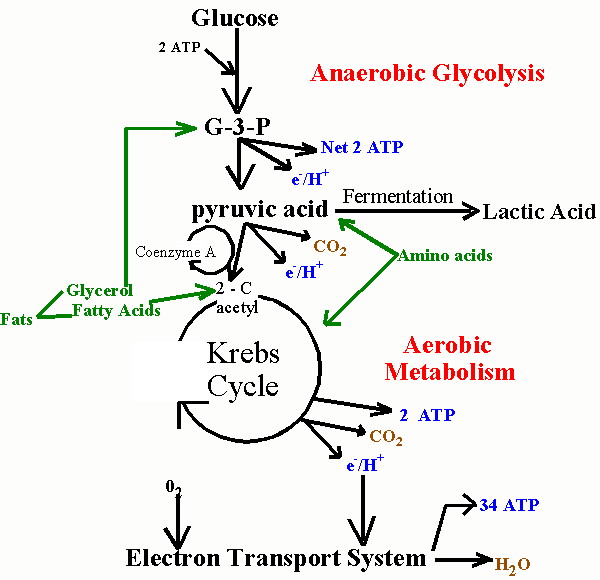
For å forklare hvordan statiner skade musklene, vil jeg først må forklare hvordan musklene administrere sine energibehov. Muskler krever en betydelig mengde energi til kontrakt, og de får det meste av denne energien ved å bryte ned fettsyrer og glukose hentet opprinnelig fra mat kilder. Som alle eukaryote celler (celler som inneholder en kjerne), muskelceller er i stand til å generere en rekke av energi gjennom aerobe (oksygenkrevende) prosesser som er sekvestrert innenfor spesielle energigenererende underområder i celle kalt mitokondrier. Dette aerob metabolisme er svært effektiv, genererer så mange som 30 enheter av ATP (adenosin trifosfat) til hvert molekyl av glukose. ATP kan betraktes som en energiverdi, fordi det lett kan brytes ned for å AMP (adenosin monofosfat) og frigjør den lagrede energi i prosessen.
Dessverre, prosessen med metabolizing mat kilder til energi er ganske komplisert. Jeg har funnet to bilder som skildrer mat metabolisme i komplementære måter, hvor den ene (ovenfor, til høyre) viser kjemiske reaksjoner og den andre (nedenfor, til venstre) schematizes de områder av cellen som er involvert. De bruker litt annen nomenklatur, men jeg vil prøve å koble dem sammen når det er nødvendig. Når glukose først kommer inn i cellen (formidlet via insulin), blir det omdannet til pyruvat (også kalt pyrodruesyre) i cellenes cytoplasma (hovedrommet i cellen). Denne prosessen frigjør en liten mengde av ATP, men krever ikke oksygen, noe som gjør det nyttig når oksygen er en mangelvare. Pyruvat kan også bli brutt ned til laktat (også kalt melkesyre) (gjæring, oksygen fraværende i figuren nedenfor) i cytoplasma, uten behov for oksygen, såkalt anaerob metabolisme, for å frigjøre ytterligere energi. Denne veien er viktig for muskelcellene under forhold med ekstrem trening, når oksygentilførselen bli utarmet.
Større Figuren viser en mer detaljert forklaring av elektrontransportkjeden prosess som foregår langs veggen omslutter mitokondrie, genererer en stor prosentandel av cellens energibehovet i prosessen. Elektrontransportkjeden injiserer protoner (H+) i intermembranrommet, i hovedsak å opprette et batteri (ladning forskjellen over membranen) som kan deretter fullføre prosessen med å konvertere (brukt) AMP tilbake til ATP som en fornyet energikilde. Hvis det er en utilstrekkelig tilførsel av koenzym Q10 (også kjent som “ubiquinone”, “Q” i figuren), så 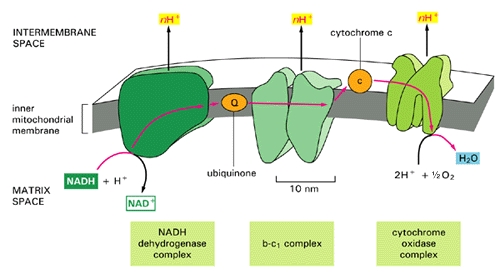 elektrontransportkjeden vil ikke virke så effektivt. Hydrogenioner kan lekke tilbake i mitokondrie gjennom en passiv prosess, som krever en mye større forbruk av energi for å skyve dem tilbake ut [20]. Batteriladningen vil bli redusert, og det vil bli en reduksjon i mengden av ATP som kan genereres. Nettoeffekten vil være svært lik virkningen av utilstrekkelig oksygen, med hensyn til energi som genereres. Imidlertid vil det være mye mer ødeleggende fordi, istedenfor å være fraværende, er det oksygen som er tilstede, men bare delvis er omdannet til vann (2 H+ + 1/2 O2 -> H2O på høyre side av figuren), siden kjede av hendelser blir holdt opp ved “Q” posisjon. Forskjellige svært giftige ladede ioner som inneholder oksygen, for eksempel -OH, H2O2 (hydrogenperoksid) og * OH, vil hvile og føre til ødeleggelser på muskelcellen, som man vil se senere.
elektrontransportkjeden vil ikke virke så effektivt. Hydrogenioner kan lekke tilbake i mitokondrie gjennom en passiv prosess, som krever en mye større forbruk av energi for å skyve dem tilbake ut [20]. Batteriladningen vil bli redusert, og det vil bli en reduksjon i mengden av ATP som kan genereres. Nettoeffekten vil være svært lik virkningen av utilstrekkelig oksygen, med hensyn til energi som genereres. Imidlertid vil det være mye mer ødeleggende fordi, istedenfor å være fraværende, er det oksygen som er tilstede, men bare delvis er omdannet til vann (2 H+ + 1/2 O2 -> H2O på høyre side av figuren), siden kjede av hendelser blir holdt opp ved “Q” posisjon. Forskjellige svært giftige ladede ioner som inneholder oksygen, for eksempel -OH, H2O2 (hydrogenperoksid) og * OH, vil hvile og føre til ødeleggelser på muskelcellen, som man vil se senere.
Det finnes en rekke sjeldne genetiske lidelser som involverer mutasjoner i gener som koder for enzymer som opererer innenfor elektrontransportkjeden [23] [32]. Særlig relevant for vår historie er Complex i enzymer, fordi Koenzym Q10 er en av dem. En interessant case study involvert to søstre [23], som begge led av en genetisk mutasjon som fører til en defekt identifisert til å være assosiert med NADH-koenzym Q10 kompleks. Som ville bli forutsagt, de led av vesentlig redusert forekomst av respiratorisk metabolisme (den fremgangsmåte som er diskutert ovenfor). De var også svært svak og hadde merket intoleranse for trening. Når de benyttes, deres nivåer av laktat og pyruvat økte kraftig i blodet, en indikasjon på at de stolte på anaerob gjæring i cytoplasma i stedet for aerob metabolisme i mitokondriene for å møte energibehovet.
5. Administrerende Energi Behov Under Ekstreme Ovelsen
Når en frisk person opplever ekstrem trening, for eksempel kjøre en 500 meter dash, musklene utfordret til å komme opp med tilstrekkelig ATP å tilfredsstille sine energibehov. Både oksygen og glukose kan bli utarmet. For å kompensere for disse manglene, er muskelceller utviklet et komplekst sett av strategier, som opererer i cytoplasma i stedet for i mitokondriene. De innebærer en rekke enzymer som vil gjenoppstår senere i vår historie, siden de er enzymer som er overvåket for å avgjøre om statin narkotika er skadelig muskler og/eller leveren.
Som du allerede har sett, er en mulighet til å generere melkesyre anaerobt (uten å forbruke oksygen), men dette gir likevel bare 1/6 så mye ATP som den aerobe prosessen foregår i mitokondriene. Prosessen med å generere energi fra ATP som skjer i to trinn: ATP først omdannes til ADP (adenosin-difosfat), og til slutt til AMP (adenosin monofosfat). Når overskudd av AMP akkumuleres i muskel celle, blir cellen overtalt til å ta opp ekstra glukose, som snart vil utarme tilførsel (glukose) i blodet hvis leveren effektivt kan regenerere mer. ADP kan konverteres tilbake til ATP ved hjelp av et enzym, kreatinkinase. I tillegg er det omdannelsen av pyruvat (generert anaerobisk fra glukose) til laktat krever hjelp av et annet enzym, laktatdehydrogenase. Laktat bygger seg opp når oksygen er utilstrekkelig, og frigjøres i blodstrømmen. Heldigvis er hjertet i stand til å benytte laktat som et alternativt brennstoff kilde [9], som blir særlig viktig i tider med ekstrem trening.
For at leveren for å generere mer glukose, trenger den et substrat. På kort sikt kan musklene levere dette underlaget, men det krever selv kannibalisering. Under korte perioder med sult, humane muskelceller tilpasse seg raskt ved å bryte ned muskelproteiner og omdanne dem til en basisk aminosyre, alanin [34]. Muskler da stole på en ny mekanisme som involverer en utveksling system med leveren, den såkalte glukose-alanin syklus. Den alanin, avledet fra muskelprotein, er sluppet inn i blodet og sendes til leveren som skal benyttes for energiproduksjon, som vist på den medfølgende figur. Leveren kan deretter generere mer glukose fra alanin gjennom glukoneogenese, under eksport av avfallsproduktet, urea, til nyrene for utskillelse. Dette gjør også at leveren til å regenerere noen ATP å tilfredsstille sine egne energibehov, som er meget stor under slike stressende forhold. Glukosen sendes gjennom blodstrømmen til muskelcellen, som ivrig tar den opp for å generere mer ATP for seg selv. Den anaerobe behandlingen av glukose gir pyruvat som også kan gjøres om til alanin, men det er behov for enda et annet enzym for å fungere. Således, når pyruvat ikke kan sendes til mitokondriene på grunn av utilstrekkelig oksygen, kan den eventuelt omdannes til alanin ved hjelp av et enzym, ALT (alanin aminotransferase), 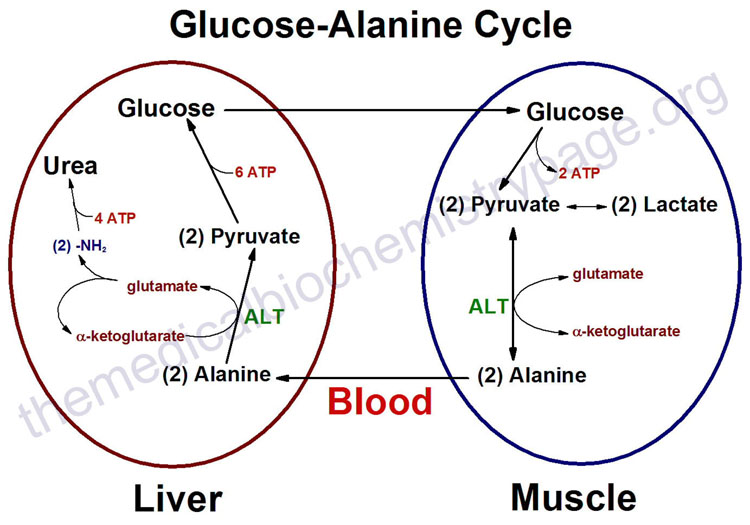 så lenge det er en god tilførsel av glutamat, som omdannes til a-keto-glutarat i prosessen.
så lenge det er en god tilførsel av glutamat, som omdannes til a-keto-glutarat i prosessen.
I den ovenstående diskusjon har flere enzymer blitt identifisert som må være til stede for disse cytoplasmatiske energi-genererende prosesser for å fungere. Disse omfatter kreatin kinase, laktat-dehydrogenase, og ALT. Den såkalte leverenzymtest som gjennomføres rutinemessig med statinbrukerne måler konsentrasjonen av ALT i blodet. Muskelenzymer detektere creatinkinaseaktivitet og lactat-dehydrogenase-konsentrasjoner i blodet. Så disse testene er alle måling av disse spesielle enzymer fordi de signaliserer at musklene blir fortrinnsvis behandling av glukose anaerobt i cytoplasma i stedet for aerobt i mitokondriene; dvs. at mitokondriene ikke fungerer. Du bør holde dette punktet i bakhodet når vi vil se det senere.
6. Extreme Trening Kan Føre Til Rabdomyolyse
Når folk engasjere seg i ekstrem trening som langdistanse maraton eller vektbærende øvelser, de kjører risikoen for å forårsake alvorlig skade, både for sine muskler og deres nyrer, på grunn av stress pålagt deres system i å prøve å opprettholde tilstrekkelig energi til drivstoff musklene. Det er blitt vanlig praksis å måle nivåene av kreatinkinase i blodet som en kjent indikator på potensiell skade [5]. En person som kreatinkinase nivå blir alarmerende høy vil sannsynligvis trenge øyeblikkelig medisinsk hjelp for å unngå nedsatt [nyre] svikt.
Årsaken til nyresvikt er mest sannsynlig myoglobin som har blitt dumpet inn i blodstrømmen ved hjelp av kompromitterte eller døde muskelceller, på grunn av rabdomyolyse. Dersom for mye myoglobin frigjøres, spesielt med utilstrekkelig vanntilførsel, kan det myoglobin blokkere nedsatt filtreringssystem som forårsaker en tilstand kjent som “akutt tubulær nekrose.” Problemet kan lett oppdages ved å observere fargen på urinen, som vil være mørk brun. En undersøkelse publisert i 2009 viste at, i rabdomyolyse, er skade på nyrene innebærer direkte interaksjon mellom myoglobin og mitochondria i nyreceller [33]. Den resulterende oksydasjon av de mitokondrielle membraner fører til åndedrettssvikt og påfølgende celledød.
Myoglobinuria er den betegnelse som beskriver nærværet av myoglobin i urinen, vanligvis på grunn av rabdomyolyse. I henhold til [37], 15% av pasienter med alvorlige myoglobinuria utvikle akutt nyresvikt, og det er forbundet med høy dødelighet. Dialyse eller intravenøs væske må innføres raskt nok, eller at personen ikke vil være i stand til å komme seg.
Så tidlig som i 1991, en gruppe japanske forskere [38] har vist at koenzym Q10 kan administreres oralt for å beskytte rotter fra muskelskader på grunn av anstrengende trening. De har også lagt merke til at rotter som ble administrert koenzym Q10 ikke har forhøyede nivåer av kreatinkinase og laktat dehydrogenase, mens kontrollrottene gjorde.
7. Myoglobin: Den gode, Den Onde Og Den Grusomme
Myoglobin er et unikt protein spesielt tilpasset for muskelceller for å hjelpe dem med deres enorme behov for oksygen. Sin fysiske struktur er skjematisert i figuren til høyre. Den ligner hemoglobin ved at den inneholder en sentral heme element (skjematisert i rødt på figuren), hvis aktive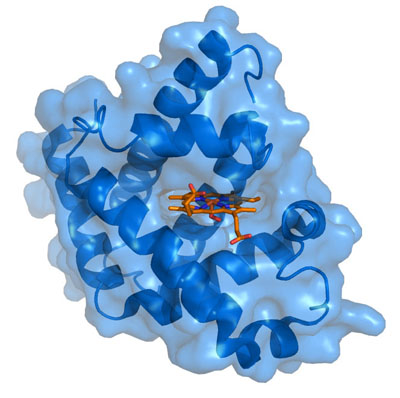 ingrediensen er en enkelt ladet atom jern (Fe). Mens hemoglobin, finnes i røde blodceller, transporterer oksygen fra lungene til alle vev i kroppen, for å myoglobin funksjoner å lagre overskytende oksygen i muskelcellen, til å bufre tilførsel i løpet av perioder med høy etterspørsel. Det transporterer oksygen fra celleveggen til mitokondriene. Selv med hjelp fra myoglobin, er det ofte slik at musklene må ty til anaerob metabolisme etter hard trening, der melkesyre er bygget opp og sluppet ut i blodet.
ingrediensen er en enkelt ladet atom jern (Fe). Mens hemoglobin, finnes i røde blodceller, transporterer oksygen fra lungene til alle vev i kroppen, for å myoglobin funksjoner å lagre overskytende oksygen i muskelcellen, til å bufre tilførsel i løpet av perioder med høy etterspørsel. Det transporterer oksygen fra celleveggen til mitokondriene. Selv med hjelp fra myoglobin, er det ofte slik at musklene må ty til anaerob metabolisme etter hard trening, der melkesyre er bygget opp og sluppet ut i blodet.
Myoglobin eksisterer i minst tre forskjellige former, som kan karakteriseres som Mg2 (Jern), Mg3 (Ferric), og Mg4 (Ferryl), avhengig av mengden av ladning som er til stede på det sentrale atom jern . Som Mg2, sin sunne tilstand, vil det lett ta opp oksygen og lagre det, mens det, når det omdannes til Mg3 ved tilsetning av en proton, blir det inerte. Imidlertid, med tillegg av nok et proton, blir det Mg4, En svært giftig reaktivt middel som vil begynne å bryte ned de fettsyrene som inneholdes i den ytre celleveggen til muskelcelle (såkalt peroxydativ skade) [35], og gå videre for å ødelegge kolesterol i celleveggen så vel [31]. Myoglobin blir Ferryl myoglobin i nærvær av overskytende mengder av frie radikaler, det vil si, i henhold til oksidativt stress indusert av svært reaktive oksygenforbindelser som hydrogenperoksyd. Huske at, med statin terapi, blir hydrogenperoksyd utviklet i mitokondriene, fordi prosessen med å bryte ned oksygen og omdanne det til vann er ufullstendig – på grunn av utilstrekkelig tilførsel av koenzym Q10.
En utmerket artikkel som beskriver prosessen der en celle er skadet av oksidativt stress ble skrevet av John Farber i 1994 [13]. Han skrev: “Alle aerobe celler genererer, enzymatisk eller ikke-enzymatisk, et konstituerende fluks av O2 –, H2O2, Og muligens * OH. På samme tid, det rike antioksydantforsvaret av de fleste celler, igjen, både enzymatisk og ikke-enzymatisk, hindre at disse artene fra forårsaker celleskade. Ikke desto mindre, er det situasjoner hvor hastigheten for dannelse av delvis reduserte oksygenarter økes og/eller antioksydantforsvaret av cellene blir svekket. I begge tilfeller kan oksidativ celleskade bli resultatet.”[14, s. 17]. Prosessen med aerob oksydasjon av næringskilder for å generere energi er begrenset til mitokondriene for å beskytte bestanddelene i cytoplasma så mye som mulig. Men myoglobin som oppgave å transportere oksygen fra celleveggen gjennom cytoplasma til mitokondriene. Det kan ikke unngå oksygeneksponering, og når det leverer oksygen, det nødvendigvis må komme i kontakt med disse giftige mellomprodukter ved fremgangsmåten som til slutt omdanner oksygen til vann. En av de mest viktige roller av koenzym Q10 i muskelcellene er å nøytralisere den skader på myoglobin forårsaket av disse oksydative midler.
Når en person lider av hjerteinfarkt (iskemisk hendelse), kan avbrudd av plakk i veggen av en koronararterie resultere i obstruksjon av strømningen, forårsaker en del av sitt hjerte å oppleve en ekstrem mangel på oksygen. Men en av de farligste ved et hjerteinfarkt er den såkalte reperfusjonsperioden, når blodsirkulasjonen er gjenopprettet, men etter at cellene er utsatt for skade som følge av oksygenmangel [29]. Denne tilstanden er spesielt problematisk for hjertemuskelen, siden det er så avgjørende for overlevelse. I en studie som involverte rotter som hadde lidd av hjerteinfarkt, ble det foreslått at skaden er en direkte følge av eksponering mot Fe4 form av myoglobin (Ferryl myoglobin) [1]. På grunn av at cellene har vært i stand til å opprettholde deres fysiologiske tilstand under deprivasjon perioden, er de meget sårbare for oksidativt stress.
Når fettsyrene i en muskel cellevegg brytes ned på grunn av eksponering for toksiske Ferryl myoglobin, cellen hurtig desintegrere. På grunn av at celleveggen er ikke lenger er ugjennomtrengelig for ioner, store mengder kalsium starte farende inn i cellen, og kort tid etter at den dør [14]. Rester av døde og døende celler blir spredt i blodet, og gjør sin vei til nyrene for destruksjon. Dette fører til en enorm belastning på nyrene som noen ganger kan føre til svikt deres såvel [47], og situasjonen kaskader inn i en nedadgående spiral.
I 1994 MORDENTE et al. publiserte en artikkel som undersøkt in vitro i hvilken grad koenzym Q kunne beskytte myoglobin fra oksidativ skade [28]. Deres resultater viste overbevisende at koenzym Q kan fungere som en naturlig antioksidant for myoglobin. For å sitere den siste setningen i sin abstract: “Sammen er disse studiene tyder på at den foreslåtte funksjon av koenzym Q som et naturlig forekommende antioksidant kan godt relatert til dens evne til å redusere H2O2 [hydrogenperoksyd]-aktivert myoglobin. Koenzym Q bør derfor redusere hjerte- eller muskulære dysfunksjoner som er forårsaket av en unormal mengde H2O2“.
8. Hvordan Kolesterol Beskytter Membraner Og Sparer Energi
Pattedyrceller kan ikke overleve uten kolesterol [45]. Kolesterol finnes i den ytre vegg (cellemembran) av alle celler i kroppen. Det er også funnet i indre membraner som omgir både mitokondrier og lysosomer (svært sure beholdere av fordøyelses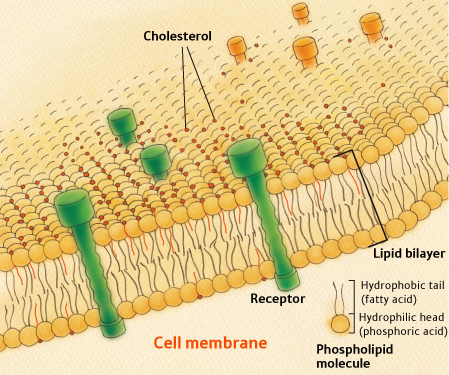 enzymer). For å forstå hvordan det fungerer kolesterol, må du vite noe om strukturen i cellemembraner. Alle cellemembraner er bygget fra en såkalt lipid bilaget, som vist i figuren til høyre. Lipidbilaget inneholder to parallelle kjeder av fosfolipider (de samme fosfolipider som omslutter LDL-partikler, det såkalte “dårlige” kolesterol). Fosfolipider har den unike egenskap at den ene enden av molekylet er hydrofobe (vann-uløselig), og den andre er hydrofile (vannløselige). De to kjeder i det ytre lipid bilaget orientere seg slik at de hydrofobe sidene av begge lag er tilgrensende i midten av membranen. Denne sentrale hydrofobe lag inneholder således fettsyrer som er utsatt for oksydativ skade. De ytre deler, som vender mot både det ytre og det indre av cellen, er vannløselige.
enzymer). For å forstå hvordan det fungerer kolesterol, må du vite noe om strukturen i cellemembraner. Alle cellemembraner er bygget fra en såkalt lipid bilaget, som vist i figuren til høyre. Lipidbilaget inneholder to parallelle kjeder av fosfolipider (de samme fosfolipider som omslutter LDL-partikler, det såkalte “dårlige” kolesterol). Fosfolipider har den unike egenskap at den ene enden av molekylet er hydrofobe (vann-uløselig), og den andre er hydrofile (vannløselige). De to kjeder i det ytre lipid bilaget orientere seg slik at de hydrofobe sidene av begge lag er tilgrensende i midten av membranen. Denne sentrale hydrofobe lag inneholder således fettsyrer som er utsatt for oksydativ skade. De ytre deler, som vender mot både det ytre og det indre av cellen, er vannløselige.
En artikkel publisert i 2009 av Kucerka et al. [22] pent oppsummerer flere kjente roller av kolesterol i membraner: “Kolesterol finnes i alle dyrecellemembraner og er nødvendig for riktig membranpermeabilitet og flyt. Det er også nødvendig for å bygge og vedlikeholde cellemembraner, og kan virke som en antioksidant. Nylig har kolesterol også vært implisert i cellesignaleringsprosesser, og er foreslått for å muliggjøre lipid flåte dannelse i plasmamembranen.” [Ibid, s. 16358] Artikkelen fortsetter med å beskrive hvordan kolesterol er i stand til å orientere seg i membranen enten vertikalt (bro over membranen) eller horisontalt (sekvestrert i den hydrofobe sentrale rom av membranen lipidbilaget). Slik den er orientert avhenger av den grad til hvilken fettsyrene i membranen er mettet, med mettede fettsyrer i stor grad begunstiger den vertikale over horisontal orientering. Kolesterol kan også vende lett fra den ene siden av bilaget til den andre. Alt av denne fleksibilitet i sin orientering inne i membranen gjør at den kan virke effektivt som et signalmolekyl.
En fascinerende artikkel skrevet av Thomas Haines i 2001 foreslått en ny, men overbevisende rolle for kolesterol i å beskytte cellemembranen fra natrium- lekkasjer [20]. Alle pattedyrceller opprettholde en ione-gradient over sin ytre vegg, som benyttes til brensel celle kjemiske prosesser. Den såkalte natrium pumpe er en aktiv prosess som kontinuerlig pumper natrium ut av cellen for å opprettholde denne ladningsforskjell. Pumpen forbruker ATP i prosessen. Arbeider mot pumpen er en passiv lekkasje mekanisme som fører til at natrium for å drive tilbake inn i cellen. I den grad at membranen kan være konstruert for å motstå lekkasje (type som setter isolasjonen i loftet i et hus), vil det kreve mindre ATP for å opprettholde natriumkonsentrasjoner som er egnet for cellen å fungere.
Haines Artikkelen hevder at cholesterol spiller en vesentlig rolle i å beskytte celleveggen fra natrium lekkasje. Natrium lekkasje er et mye større problem (det lekkasjer 7 til 11 ganger så hurtig i fravær av kolesterol) for umettede fettsyrer som for mettede fettsyrer [4]. Imidlertid umettede fettsyrer oppfordrer kolesterol for å arrangere seg i det midtre lag. Ved å akkumulere der, gir det ekstra isolasjon hindrer de ladede natriumioner fra passivt hopper fra det ytre til det indre av cellen. Andre eksperimenter [30] har vist at de relative natrium lekkasjerater er redusert med 300% i nærvær av kolesterol.
9. Bevis På Statin Skade På Muskler
Typisk i Amerika, hvis en person ikke består en stresstest eller lider av hjerteinfarkt og deretter er funnet å ha en blokkert koronararterie, vil en stent bli introdusert for å løse problemet og høydose statinterapi vil bli igangsatt, med den forventning at stoffet vil være nødvendig for resten av livet. Den aksepterte oppfatning i dag er at, uansett om deres kolesterol allerede er lav, vil høydose statinterapi gi tilstrekkelig fordel å kompensere for eventuelle bivirkninger som den kan forårsake. Samtidig er disse pasientene oppfordres til å bruke opptil en time om dagen trening på en tredemølle, siden trening har vist seg å være svært gunstig for hjertesykdom prognose. Den oppgave, i forbindelse med de metaboliske mangler indusert av statin stoffet, er en potensielt dødelig kombinasjon.
Typisk er også, at pasienten ikke er varslet om at en vanlig bivirkning av statinene er muskelsmerter og muskelsvakhet. Det er ofte slik at slike symptomer ikke vises umiddelbart. Faktisk kan det noen ganger være år før statinbehandling fører til nok skade til å forårsake åpenbare symptomer. Innen den tid, kan personen godt tro at smerte og svakhet er rett og slett en konsekvens av å bli eldre.
Det har vært mye hevdet, og statinbrukerne synes å ha omfavnet dette konseptet, at så lenge du overvåke dine enzymnivåer, kan du bare avslutte statinbehandling hvis enzymene blir for høyt, og alt vil bli bra. Men dømme fra noen av de triste historiene som dukker opp i kommentarsider over hele nettet, dette har vist seg ikke å være tilfelle for noen mennesker.
En artikkel publisert i juli 2009 [27] undersøkte sammenhengen mellom fysisk muskelskader og pasientenes klager av muskelsvakhet eller smerter. Pasienter som rapporterte svakhet sagt, for eksempel at det var vanskelig å komme opp fra sittende stilling uten arm støtte. De som rapporterte smerter generelt sagt at det var verre etter fysisk trening. Bare én av 44 pasientene som ble undersøkt utviklet overt rabdomyolyse, med serumnivået av muskelen enzymet kreatinkinase målt ved 57 657 U/l. Denne pasienten nødvendig sykehusbehandling for forvaltning av hans smerte.
Forfatterne var interessert i å undersøke i hvilken grad muskelskade kan ses gjennom muskelbiopsi for disse pasientene. De sammenlignet dem med 20 pasienter som aldri hadde tatt et statin narkotika. Tjue fem av de 44 pasientene som tok statiner hadde klart muskelskade. Ingen av de 20 kontrollene hadde noen tegn på skade. Annet enn én pasient med overt rabdomyolyse, ingen av de andre hadde muskelenzymnivåer over cut-off ansett det øvre nivået av “normal”. For de pasienter med skader, i gjennomsnitt 10% av fibrene ble skadet. Forfatterne konkluderte med at mangelen på forhøyede nivåer av kreatinkinase utelukker ikke strukturell muskelskader.
10. Statiner Og Hjertesvikt
En publikasjon med tittelen ganske enkelt “Lovastatin reduserer koenzym Q-nivå hos mennesker” [16] angir utvetydig i den abstrakte: “Det er fastslått at koenzym Q10 er uunnværlig for hjertefunksjon.” Hjertet er en muskel, og derfor er utsatt for all samme fysiske lover som skjelettmuskulaturen. Den står overfor det samme problemet med brensel mangel på grunn av de forskjellige effekter statiner har på metabolismen diskutert ovenfor. Hjertemuskelcellene vil også måtte slutte seg til å få nok drivstoff, og vil også lider skade på cellemembraner som følge av eksponering for Ferryl myoglobin.
En artikkel publisert i 2004 [42] gir en plausibel teori for den prosessen som muskelceller i hjertet blir dysfunksjonelle med alderdom, fører til slutt til hjertesvikt. Argumentet passer perfekt med de logiske fradrag knyttet til mekanismen som statiner skader celler og fører til den uunngåelige konklusjonen at statiner gjør du alder i en akselererende tempo. Fremgangsmåten innebærer en spiral nedover forårsaket av mangler i både mitokondrier og lysosomene. Husk at mitokondriene er ansvarlig for å levere brensel til cellen, og lysosomene er ansvarlige for bearbeider og dekomponere rester av avfallsprodukter. Artikkelen hevder at den nedadgående spiral er forårsaket av “kontinuerlig fysiologisk oksidativt stress.” Oxidative stress er betydelig forbedret ved statiner fordi de utarme tilførsel av både antioksidanter som koenzym Q10 og ferske fosfolipider og kolesterol å gjenoppbygge ødelagte celleveggene. Rester fra skadede fosfolipider i celleveggen, må de mitokondrielle vegger, og lysosomet vegger tas opp av lysosomene, spaltet, og kastes. Under normale omstendigheter lysosomene ville lett bryte dem ned i deres svært sure miljøet, ved hjelp av sine kraftige fordøyelsesenzymer.
Når lysosomene er i stand til å fordøye det avfall som samler seg fra ødelagte celleveggene, er den rest som gjenstår kalt “lipofuscin”. Lipofuscin er ansett for å være en signatur av alderdom, akkumuleres i lever, nyre, hjerte-muskelen og nervecellene som vi blir eldre. Lipofuscin antas å være produktet av oksidasjon av umettede fettsyrer, og er en indikasjon på membranskade, enten til cellens ytre vegg eller til veggene i lysosomene og mitokondriene [17].
For langsiktige statinbrukerne, lipofuscin nesten helt sikkert akkumuleres, fordi deres lysosomer er dysfunksjonelle. Denne tilstanden vil oppstå ikke bare i hjertet, men i alle cellene i kroppen. Som tidligere nevnt, statiner lamme produksjonen av dolichols, antioksidanter som spiller en avgjørende rolle i å beskytte lysosomer fra hydrogenion lekkasje. Lysosomer er også avhengige av kolesterol i sine membraner for å gi ytterligere isolasjon mot kostnad spredning. Med en konstant lekkasje utad av H+ ioner, lysosomene kan ikke opprettholde pH-verdien på et tilstrekkelig surt nivå for å tillate at deres enzymer for å virke. Som en konsekvens, undegradable rusk, dvs. lipofuscin, akkumulerer i lysosomene, og cellen har ingen backup reparasjonssystem for å berge katastrofen. Den siste setningen i det abstrakte av [42] sier: “Dette henger sammen mitokondrie og lysosomal skade til slutt resulterer i funksjonssvikt og død av hjertemuskelceller {hjertemuskelcellene].”
Legen Peter Langsjoehn mener at statiner er å indusere en epidemi økning i forekomsten av hjertesvikt. Han skrev: “I min praksis fra 17 år i Tyler, Texas, har jeg sett en skremmende økning i hjertesvikt sekundært til statin bruk, ‘statin kardiomyopati. I løpet av de siste fem årene har statiner blitt mer potent, blir foreskrevet i høyere doser, og blir brukt sammen med uvøren forlate hos eldre og hos pasienter med ‘normale’ kolesterolnivåer. Vi er midt i en CHF-epidemien i USA med en dramatisk økning de siste ti årene. Er vi forårsaker denne epidemien gjennom vår ivrige bruk av statiner? I stor grad tror jeg svaret er ja.” (Statiner og hjertesvikt).
Dr. Duane Graveline, en lang tid talsmann for farene ved statinbehandling, har gitt en veldig klar beskrivelse (Duane Grave på Statiner og hjertesvikt) av rollen av koenzym Q10 i hjertet og grunnen til at dens hemming av statiner ville føre til hjertesvikt. Du kan finne flere referanser til relevante artikler av Dr. Langsjoehn på den siden.
En veldig fersk undersøkelse (november 2009) [8] fant at pasienter med diastolisk hjertesvikt som tok statiner hadde signifikant dårligere resultat enn pasienter som ikke var på statinbehandling. Diastolisk hjertesvikt skiller seg fra systolisk hjertesvikt ved at det er forbundet med dysfunksjon av hjertet under hvilefase i stedet for kontrahering fase. Men det er årsaken til nesten halvparten av tilfellene av hjertesvikt, og det er like dødelig som det systoliske form. I studien ble det bekreftet at personer med diastolisk hjertesvikt som var på statinbehandling var mer sannsynlig å ha problemer med lungene og var mindre i stand til å anstrenge seg (svakere muskler, dårligere treningstoleranse) enn de som ikke er på statiner.
11. Statiner og Lungesykdom
Statin industrien har forsøkt å fremme ideen om at statiner kan være gunstig i behandling av lungebetennelse. De kom til denne feilaktige konklusjonen gjennom retrospektive studier, hvor de observerte fordelene kommer, jeg mistenker, fra det faktum at de som tok statiner hadde dratt nytte av høyt kolesterol for sannsynligvis mange år før innføring statinbehandling. Industrien er tilstrekkelig oppmuntret av foreløpige positive indikasjoner for å deretter foreta placebo-kontrollerte studier for å forsøke å legitimere deres krav. Men studiene slo tilbake, fordi de tydelig viste at statinbehandling ikke bare ikke var nyttig, men faktisk førte til en betydelig dårligere prognose [26] [12] (se (statiner øker lungebetennelse Risk). For lungebetennelse alvorlig nok til å kreve sykehusinnleggelse, den økte risikoen pådratt ved å ta et statin ble en alarmerende 61% [12].
Statiner effekt på musklene gjelder respirasjonsmuskulaturen også, som fører til vanskeligheter med å puste, og påfølgende oksygenmangel, noe som naturligvis forverrer både lungebetennelse og hjertesvikt ytterligere. Videre er det nå velkjent at, i sjeldne tilfeller, statinene forårsake alvorlig lungesykdom, såkalt “interstitiell lungesykdom” (ILD) [24] [44] [15]. ILD er nå oppført som en sjelden bivirkning for alle statin narkotika.
I en utmerket oversiktsartikkel publisert i 2008, Fernandez et al. [15] identifisere flere muligheter for hvordan statiner kan forårsake interstitiell lungebetennelse. De begynner sin diskusjonen ved å trekke en analogi med amiodaron, til et stoff som er kjent forårsaker en meget lignende type patologi, som inkluderer akkumulering av lysosomale inklusjonslegemer, dvs. lipofuscin, den cellemembran rusk som ble beskrevet tidligere i avsnittet i henhold til hjertesykdom.
Amiodaron tilhører en meget vanlig klasse av legemidler som er kjent som “amfifile” narkotika: de har både en hydrofil (vannløselige) og en lipofile (fettløselige) komponent i deres kjemiske struktur. Denne egenskapen gjør det mulig for dem å krysse gjennom membranene av cellene for å oppnå den ønskede biokjemiske innflytelse. Imidlertid er den prosess ved hvilken de kommer inn i cellen medfører nedbryte lipider i cellemembranen [2]. Membranfragmenter bryte vekk fra celleveggen og føre stoffet sammen med dem inn i cellen. Som en konsekvens av celleveggen forringelse, vil natrium lekkasje føre til at cellen for å tape energi, med alle de negative konsekvenser som er blitt beskrevet før.
Fernandez et al. hevder at, som amiodaron, statiner har en amfifil struktur, siden de inneholder en apolar (lipofile) ring og en hydrofil sidekjede. En virkelig urovekkende observasjon de gjør er at over tid, er amfifile legemidler kjent for å bli mer effektiv ved å legge inn celler. Det virker logisk at en forverret cellevegg ville tillate bedre permeabilitet til stoffet molekylet. Men dette betyr da at uansett effekten stoffet har på cellen økes, fører til akselerert skade og en destruktiv kaskade.
Amiodaron er en potent antidysrhythmic middel, dvs. et stoff som brukes for å prøve å korrigere en uregelmessig hjerterytme i løpet av hjertesvikt eller post-operative. Den har en rekke bivirkninger, men sannsynligvis den mest alvorlige bivirkningen er interstitiell lungesykdom. En artikkel skrevet i 2001 [3] utforsket sannsynlig mekanisme for lungeskader. Forfatterne utført in vitro-eksperimenter på celler i lungevevet ekstrahert fra hamstere. De bemerket at utsettelsen for medikamentet redusert mitokondriemembranpotensialet (H+ ioner lekket ut av mitochondria) og deretter ble mengden av ATP i cellen falt med 32 til 77%. Selv med tilsetning av glukose, mitokondriene var ikke i stand til å regenerere oppbrukt ATP; dvs. mitokondriene ble ikke fungerer som den skal til å generere energi fra glukose. Til syvende og sist, cellene døde. De konkluderte med at mitokondriell dysfunksjon var banen ved hvilken legemiddel-induserte celledød.
Det de beskriver er i hovedsak den samme prosessen som statiner føre til problemer i muskelceller. Fernandez et al. enig med min argument at, som amiodaron, kan statiner forårsake interstitiell lungesykdom gjennom deres avbrytning av den mitokondrielle elektrontransportkjeden og etterfølgende uttømming av ATP. Lungeceller er særlig utsatt for oksydativ skade, fordi de har til oppgave å fange opp oksygen fra luften og transportere den til blodet. Jeg mistenker også at selv om antall tilfeller av rapporterte interstial sykdom er liten, det er et mye større antall personer som lungene har blitt kompromittert av statiner, men hvis lungefunksjon har ennå ikke forverret seg til en katastrofal punkt. I stedet, de opplever noen problemer med å puste og en opplevd manglende evne til å få nok oksygen. Som med muskelsvakhet, slike symptomer kan gå urapportert, som pasienten har ingen måte å vite at det han opplever er ikke en normal del av å bli gammel. Riktignok øker følsomheten overfor viral lungebetennelse ville være forventet når det lunge celler lider av utilstrekkelig energi og en nedbrutt celleveggen.
12. Statiner og Diabetes
JUPITER utprøving av statinet medikament crestor ble allment innledet som bevis for at statinene kan forsinke hjerteinfarkt for personer som har høye nivåer av en indikator på inflammasjon som kalles C-reaktivt protein. Imidlertid, hva som er mindre kjent om dette forsøket er at det avdekket en klar sammenheng mellom statinene (eller, i det minste, crestor) og økt risiko for diabetes (JUPITER Trial og diabetes ) [36]. Ifølge Dr. Jay Cohen, folk som tok Crestor i rettssaken hadde en 25% økt risiko for å utvikle diabetes, sammenlignet med kontrollgruppen. Dette er alarmerende, fordi diabetes i seg selv er en ekstremt sterk risikofaktor for hjertesykdom.
Bukspyttkjertelen syntetiserer insulin i sine beta-celler, og defekter i insulinproduksjon (enten for lite av det, eller en mangel på respons til det) er årsaken til diabetes. Insulin blir brukt av kroppens celler for å katalysere transporten av glukose inn i cellen. Uten insulin, eller med dårlig fungerende insulin, sukker hoper seg opp i blodet og cellene blir energi sultet.
Det har vært et stort antall studier om biokjemien av beta-cellene og deres insulin-produserende maskineri, og det er blitt bestemt at betaceller krever både kolesterol [46] og fettstoffer [11] for å være tilstede før de vil frigi insulin. Utilstrekkelig kolesterol og dårlig kvalitet fosfolipider i beta cellens ytre membran sannsynlig forringe dens evne til å transportere insulin over membranen. Statin narkotika, selvfølgelig, reduserer biotilgjengeligheten av kolesterol, men også av fettsyrer, fordi disse transporteres i blodstrømmen via de samme LDL-partikler som statiner undertrykker. Dermed er det lett å se hvorfor statiner ville føre til en økt risiko for diabetes.
I tillegg til de ovennevnte defekter i cellemembranen, svekket funksjon av mitokondriene i beta-celler er også blitt klart implisert i diabetes, i studier som involverer diabetiske mus med defekte gener mitokondrie [39]. Disse musene viste redusert insulinsekresjon når de bare var fem uker gamle, og deres mitokondrier var unormalt utseende og var ikke i stand til å opprettholde en tilstrekkelig ladning gradient på tvers av sine membraner. Med andre ord, viste de feil som ligner på hva som ville være forventet med redusert koenzym Q10 som en konsekvens av statin eksponering. Eldre mus med samme defekten var svært mangelfull i insulinproduksjon, som mange av deres pankreas beta-celler hadde dødd ut.
Insulin undertrykker frigjøring av fett fra både fettcellene og leveren, og derfor vil det være et fett mangel på blodtilførsel til påfølgende insulinfrigivelse, med mindre rikelig fett allerede er til stede. Således, er det en god strategi, biologisk, for beta-celler for å være sikker på at fett og kolesterol er vel som følger før injisering av insulin inn i blodstrømmen. Jeg har tidligere skrevet mye om dette temaet (metabolsk syndrom forklart).
En undersøkelse publisert i mars 2009 [41] sett på forholdet mellom statin medikamentbruk og fastende blodglukosenivåer, testen typisk utført for å vurdere risiko for diabetes. De gruppert 345,417 pasienter i to kategorier: med eller uten en foregående diabetes diagnose. De sammenlignet fastende glukose nivå før de begynte å ta statiner og deretter etter at de hadde vært på statiner for et gjennomsnitt på to år. I begge gruppene, de oppnådd en meget signifikant (P <0,0001) på grunn av økte fastende glukosenivåer for de på statin terapi.
En reduksjon i evnen til glukose for å angi muskelceller, følge til en reduksjon i insulintilførsel, ville legge fornærmelse til skade for muskelcellene prøver å overleve med en defekt aerob metabolisme fabrikken. På grunn av at musklene blir tvunget til å skifte til den mye mindre effektiv anaerob metabolisme av glukose for å unngå oksidativ skade, de krever enormt mer glukose til å møte deres energitilførsel enn de ville kreve hvis deres mitokondrie energi-genererende fabrikk ble virker skikkelig. Likevel redusert insulin er å gjøre det vanskeligere å få nok glukose i. Dette vil tvinge cellen inn i sult-modus som fører til cannibalization av dets indre muskelprotein. Den oppfattes resultat over tid vil være ekstrem muskelsvakhet.
13. Konklusjon
Hvis du bor i USA, og legen har identifisert at du har høy risiko for hjerteinfarkt, har han sannsynligvis foreskrevet en dose statin høy selv om kolesterolnivået er ikke høy. Du har sannsynligvis også blitt satt på en lav-fett, lite mettet fett diett, og du har blitt oppfordret til å trene på en tredemølle hver dag.
Min forskning viser at hvis du strengt følger alle legens råd, vil du stå overfor alvorlige muskelskader før eller senere. Statin stoffets innvirkning på mitokondrier og på celleveggene i muskelcellene er slik at til og med beskjedne trening kan føre til rabdomyolyse. For noen vil det være opplagt med en gang at bivirkningene er også skadelig og statinbehandling må avsluttes. For andre, vil skaden skje mer snikende, og vil ikke bli klart før år etter statinbehandling ble igangsatt. Men ofte pasienter vil oppleve at symptomene fortsatt etter at stoffet er stoppet – vil det være for sent å reparere muskelskader. Eller, enda verre, vil de utvikle nyresvikt eller hjertesvikt som følge.
Statin narkotika har mange negative bivirkninger, men trolig den mest hyppige klager bekymring muskelsmerter og muskelsvakhet. I dette essayet, har jeg utviklet en fysiologisk forklaring på mekanismen ansvarlig for denne bivirkningen. Det er grunn til det faktum at statiner forstyrrer syntesen av ikke bare kolesterol, men også koenzym Q10 og dolichols. Statiner reduserer også biotilgjengeligheten til celler av både fettsyrer og alle diett antioksidanter, på grunn av den kraftige reduksjonen i serumnivåer av LDL, som leverer disse essensielle næringsstoffer til cellene.
Uten tilstrekkelig koenzym Q10, muskelceller lider av en svekket evne til å generere energi til at sammentrekninger. De er tvunget til å slutte med sine egne proteiner for å overleve. På samme tid, er kraftige oksydative midler som genereres som skader den myoglobin i cellen, slik at det både ineffektiv til å transportere oksygen og giftig for celleveggen. Den oksyderte myoglobin, kjent som “Ferryl myoglobin” er giftig for de fettsyrer som er hovedkomponenten i celleveggen. Med utilstrekkelig kolesterol i celleveggen, kan cellen ikke holde en belastning, og dette fører også det å kaste bort energi. Lysosomene er ikke i stand til å fordøye rusk fordi de ikke kan opprettholde en tilstrekkelig surt miljø. Problemet blir ytterligere forsterket av dyptgripende mangel på kolesterol, som ville ha tilbudt ytterligere beskyttelse mot oksidativ skade på fettsyrene og ion lekkasje i celleveggen, mitokondrie vegg, og lysosomet vegg. Til slutt cellen går i oppløsning og myoglobin er sluppet inn i blodstrømmen. Det gjør veien til nyrene, som prøver å kvitte seg med den. Men Ferryl myoglobin er også giftig for nyrene, noe som fører til alvorlig nyresykdom.
Lav-fett diett og mosjon regime vil både øke sannsynligheten for at statin narkotika vil føre til problemer. Hard trening øker energibehovet til musklene, mens det lav-fett diett reduserer ytterligere den biologiske tilgjengelighet av fettsyrer å erstatte ødelagte celleveggene. Videre er cellevegger er sammensatt av umettet fett er mer utsatt for angrep av den Ferryl myoglobin enn de som er sammensatt av mettet fett.
Fordi hjertet er også en muskel, det også lider skade på grunn av eksponering for statiner. Dette fører til en redusert sannsynlighet for å utvinne fra en diastolisk hjerteinfarkt, og en økt sannsynlighet for å utvikle hjertefeil. Skadede celler i åndedrettsorganene fører til en økt risiko for både lungebetennelse og interstitiell lungesykdom, som begge er meget farlig for en person med et svakt hjerte.
JUPITER rettssaken avdekket at behandlingsgruppen hadde en 25% økt risiko for diabetes, og jeg har forklart ovenfor hvorfor dette skulle være sant. Diabetes er en betydelig risikofaktor for hjertesykdom, så dette resultatet er urovekkende, og en lurer på om rettssaken ble avsluttet tidlig for å unngå å gjøre dette tallet enda verre. Dr. William Davis, en kardiolog som mener at statiner bør være en siste utvei i behandling av hjertesykdom, har dette å si om JUPITER rettssaken: “Jeg vil vise foisting av Crestor via JUPITER argument på det offentlige som tar full nytte av den hjelpeløs situasjon mange amerikanere befinner seg i: Reduser fettinntaket, spise mer sunn hele korn og. . . kolesterol og CRP skyte i været! ‘Du må Crestor! Se, jeg fortalte deg at det var genetisk, sier legen etter behandlende fint Astrazeneca-sponset narkotika middag.” (Dr. Davis’ blogginnlegg på JUPITER)
Nyheten har nettopp kommet ut at selv barn blir nå testet for høyt kolesterol, og det blir foreslått at de skulle bli satt på et statin narkotika hvis de ikke kan kontrollere kolesterolnivået (Barn statiner ??). Jeg finner denne nyheten til å være ekstremt urovekkende, spesielt siden ingen av de kontrollerte statin studier har vært utført på barn. Vi har ingen anelse om hva negative konsekvenser statin narkotika kan ha på å utvikle nervesystemet av et barn. Imidlertid har det vist seg at statiner kan fullstendig ødelegge nervesystemet til et embryo [13].
En bemerkelsesverdig fersk publikasjon av Jeff Cable (Desember 2009) [7] analyser et sett av 885 selv rapporterte uheldige virkninger av statin behandling av pasienter. Selv om rapporter dekket et bredt område av kjente bivirkninger av statiner, inkludert kognitiv svekkelse, muskelsmerter og svakhet, hudproblemer og seksuell dysfunksjon, det som var mest forstyrrende var et stort antall rapporter om alvorlige nevrologiske skader. Mest foruroligende var det faktum at det var totalt 17 rapporter om ALS med 2 ekstra rapporter knyttet til motoriske nervecellen forverring, som han teller sammen som ett for å gi et totalt 18. I ALS, nerveceller kaste bort eller dø, og kan ikke lenger sende meldinger til musklene. Dette fører til slutt til muskel svekkelse, rykninger, og til slutt lammelser. Etter hvert som sykdommen utvikler seg, å svelge og puste bli vanskelig. De fleste ofrene dør innen fem år etter diagnose.
Forfatterens kommentarer som er knyttet til nevrologiske lidelser og ALS er sitert her: “En fragment av informasjon som ble oppnådd fra pasient konti er det tydelig forekomsten av store neurodegenerative sykdommer som godt kan ha blitt utfelt ved statin terapi. … Den sjeldneste av disse forholdene er ALS og likevel på bare 351 rapporter var det nok tilfeller å ha gjort prediksjon (basert på forekomst statistikk) at en forventet tre millioner seks hundre tusen kontoer måtte bli skrevet før atten ALS/MND tilfeller ville har blitt avslørt. Dette er en så utrolig høyt antall tilfeller å rapportere innenfor et så lite deltaker gruppe at det ville være riktig å spørre om det er gjort en fundamental feil. Fraværende noen feil er det også riktig å spørre: Hva er det egentlig som skjer? Hva er den reelle risikoen som utgjøres av statinbehandling?”
Det er tidligere bevis fra litteraturen impliserer et forhold mellom statiner og ALS – en studie av FDA bivirkningsrapporter [10], så vel som en studie som viser at høyt kolesterol beskytter mot ALS [19]. Min neste essay vil være på temaet statin narkotika sannsynlige negative effekter på nervesystemet: Jeg vil hevde at statiner øker risikoen ikke bare for å ALS, men til multippel sklerose, Parkinsons sykdom, og Alzheimers.
Bekreftelser
Jeg vil gjerne takke Glyn Wainwright for å peke meg til både sin egen utmerket anmeldelse papir og meget informativ og fascinerende artikkel av Haines [20] på proton og natrium lekkasjer gjennom lipidbilagene, som spilte en avgjørende rolle i mine argumenter for statin skade muskler.
Statiner og myoglobin: Hvordan muskelsmerter og svakhet Progress to Heart, Lung og nyresvikt av Stephanie Seneff er lisensiert under en Creative Commons Attribution 3.0 USA License.
